Le séquençage, cet indispensable outil pour traquer le virus
Publié le - par LeBlob.fr, avec l’AFP
Pour surveiller les modifications du coronavirus susceptibles d’aggraver la pandémie ou de rendre les vaccins moins efficaces, les scientifiques doivent séquencer son génome. Mais peu de pays effectuent et partagent cette surveillance laborieuse, complexe et nécessaire. Les experts s’inquiètent donc autant des mutations à risque qui passent sous les radars que de celles qu’ils peuvent repérer.
La publication de la première séquence génomique du SRAS-CoV-2 en janvier 2020, au tout début de la pandémie, a permis de l’identifier comme un nouveau coronavirus et commencer à développer des tests de diagnostic et des vaccins. Depuis, des dizaines de milliers de séquences ont été téléchargées sur des bases de données publiques, permettant de suivre les mutations avec une précision et une vitesse jamais atteintes auparavant.
La part du lion de ces informations provient d’un seul pays : la Grande-Bretagne. Mi-janvier, GISAID – une importante plateforme de partage de données créée à l’origine pour surveiller la grippe – avait reçu 379 000 séquences. Parmi celles-ci, 166 000 provenaient de Covid-19 Genomics UK (COG-UK), un partenariat entre autorités sanitaires et établissements universitaires.
« C’est la première fois que nous voyons comment un agent pathogène évolue à cette échelle », relève Ewan Harrison, directeur de la stratégie et de la transformation au COG-UK et membre du Wellcome Sanger Institute, où une grande partie du séquençage est effectuée. « Nous apprenons que ces mutations s’accumulent bien plus vite que nous ne le pensions ».

Actuellement, le programme séquence 10 000 génomes par semaine (environ 6 % des cas connus en Grande-Bretagne) et l’objectif est de doubler ce chiffre. « Le Royaume-Uni a écrasé tout le monde », déclare Emma Hodcroft, épidémiologiste à l’Université de Berne et co-développeuse du projet international de suivi du virus, Nextstrain. Le Danemark, relève-t-elle, séquence et partage aussi régulièrement les données, mais les informations provenant de la plupart des autres pays sont au mieux sporadiques.
Le séquençage, une priorité
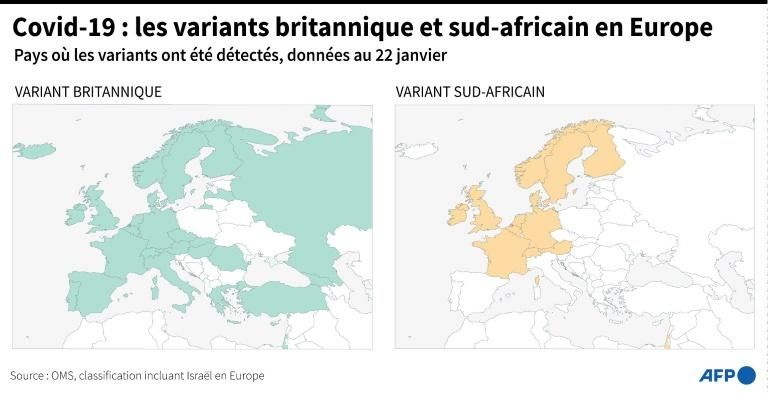
Le séquençage a identifié des variants préoccupants en Grande-Bretagne, en Afrique du Sud et au Brésil.
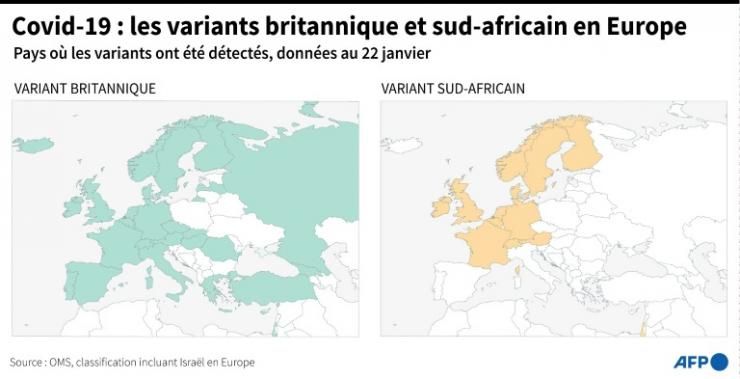
Le nouveau variant à propagation rapide au Royaume-Uni est « comme une mini-pandémie au sein de la pandémie », dit le Dr Harrison. Sans surveillance systématique, les scientifiques n’auraient peut-être pas encore compris qu’il « change la donne ». L’alerte précoce n’a pas empêché sa propagation – des dizaines de pays l’ont détecté – mais elle a permis à d’autres de se préparer. Sans l’avertissement des scientifiques britanniques, le monde naviguerait à l’aveuglette, renchérit Emma Hodcroft.
D’autres variantes du virus ne sont devenues visibles que lorsqu’elles se sont répandues à l’international à partir de leur point d’origine. Ce mois-ci par exemple, une nouvelle souche, porteuse d’une mutation appelée E484K et dont les chercheurs craignent qu’elle puisse échapper à l’immunité, a été identifiée au Japon chez des personnes arrivant du Brésil.
Pour l’Organisation mondiale de la santé (OMS), une meilleure capacité de séquençage est une priorité. Maria Van Kerkhove, responsable technique Covid-19 de l’OMS, a récemment qualifié d’« incroyable » le nombre de séquences partagées jusqu’à présent, mais déplore qu’elles ne proviennent que d’une poignée de pays. « Améliorer la couverture géographique du séquençage est essentiel pour que le monde ait des yeux et des oreilles (braqués) sur les changements du virus », a-t-elle déclaré sur un forum en ligne.
Selon l’OMS, une « révolution » dans l’investigation génomique des virus a contribué à une meilleure compréhension de plusieurs maladies, d’Ebola à la grippe. « Pour la première fois, le séquençage génomique peut aider à guider la réponse de santé publique à une pandémie en temps quasi réel ». Lorsqu’un autre coronavirus, le SRAS, a commencé à se propager en 2002, seules trois variantes du génome ont été partagées publiquement pendant le premier mois et 31 au troisième mois.

Cette fois, six génomes étaient à la disposition des chercheurs du monde entier quelques semaines après l’apparition du virus. En six mois, 60 000 étaient publiés.
Un trajet en minibus
Au départ, le nouveau coronavirus n’a pas montré beaucoup de diversité génétique, indique Emma Hodcroft, même s’il « a explosé à travers l’Europe ».
« Nous avons pu voir qu’il semblait vraiment provenir de Chine, car toutes les séquences détectées dans le monde se retrouvaient dans les diverses séquences chinoises », précise-t-elle. À l’été 2020, de nouvelles souches sont apparues, remplaçant les versions précédentes du virus. Les mutations font partie de l’évolution virale et se produisent lorsque le virus se réplique. Il s’agit « essentiellement de faute de frappe », explique la Dr Hodcroft.

La plupart des nouvelles souches ne confèrent aucun avantage au virus, certaines lui sont même défavorables. Mais parfois, une mutation augmente le caractère infectieux ou provoque une maladie plus grave.
Plus un virus infecte de gens, plus la possibilité de mutation est grande, et la probabilité augmente chez une personne dont le système immunitaire est chroniquement affaibli. C’est peut-être ainsi que le nouveau variant est apparu au Royaume-Uni, et les chercheurs séquencent maintenant les souches provenant de patients immunodéprimés, indique le Dr Harrison, de COG-UK.
Le séquençage systématique à l’échelle nationale a donné aux chercheurs de nouvelles perspectives sur la transmission virale. Cela a permis par exemple d’identifier un trajet en minibus (dans lequel étaient transportées un groupe de personnes) comme origine d’un foyer épidémique dans un hôpital. L’étape suivante consiste à étudier comment les différentes mutations affectent la transmission du virus, la gravité de la maladie et l’efficacité du vaccin, et à prédire le plus rapidement possible le comportement d’un nouveau variant.
Pour l’OMS, le séquençage mondial aidera « à mieux comprendre le monde des agents pathogènes émergents et leurs interactions avec les humains et les animaux dans une variété de climats, d’écosystèmes, de cultures, de modes de vie, etc. ». Mais le séquençage à grande échelle est complexe sur le plan logistique. L’Institut Wellcome Sanger, au sud de Cambridge, en Angleterre, stocke les dizaines de milliers d’échantillons qu’il reçoit chaque jour dans d’énormes congélateurs et il a conçu toute une infrastructure robotique pour les trier et les utiliser dans ses recherches.