Covid-19 : une fois un vaccin autorisé, le dilemme éthique autour des volontaires placebo
Publié le - par Le Blob.fr, avec l'AFP
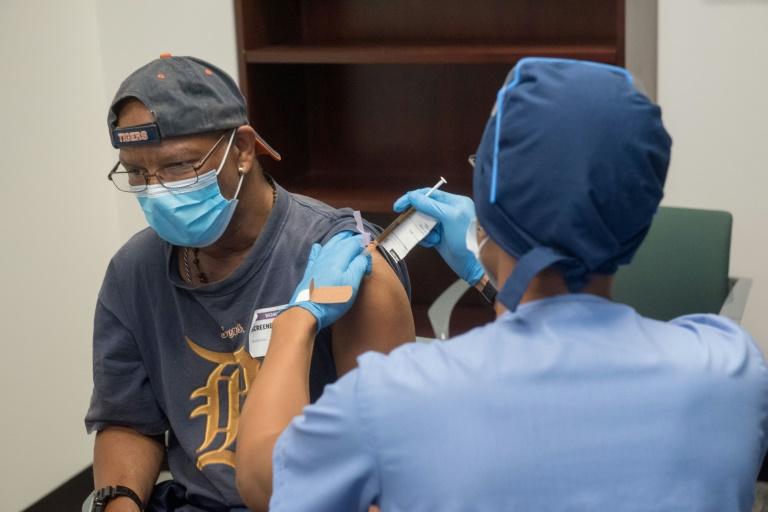
Si un vaccin était autorisé aux Etats-Unis avant la fin de l'année, les participants aux essais cliniques ayant reçu un placebo se rueraient-ils sur le vaccin approuvé ? La question tourmente les industriels et les autorités sanitaires, car leur départ compliquerait l'évaluation à long terme des vaccins.
Actuellement des dizaines de milliers de personnes aux Etats-Unis, et dans d'autres pays, se sont portées volontaires pour participer à des essais cliniques dits de phase 3. En général, la moitié reçoit le vaccin expérimental, l'autre moitié un placebo, en aveugle. Le but est d'observer, au fil des mois, combien de personnes dans chaque groupe contractent naturellement le coronavirus et tombent malade du Covid-19. Si la réduction dépasse 50% dans le groupe vacciné par rapport au groupe témoin, alors l'Agence américaine des médicaments (FDA) pourrait juger le vaccin efficace et lui accorder ce qui s'appelle une autorisation d'utilisation en urgence. Mais pour une autorisation permanente, la FDA a besoin d'un suivi plus long, en général de six mois, afin de confirmer l'innocuité du vaccin, certains effets secondaires rares pouvant ne pas être détectés dans les deux mois de suivi actuellement prévus pour l'autorisation conditionnelle.
Le problème est qu'en général, pour des raisons éthiques, une fois qu'un médicament ou un vaccin est autorisé, les participants ayant reçu le placebo dans un essai clinique sont informés. Ils pourraient alors demander le vrai vaccin, ou indépendamment aller se faire vacciner, mais ce faisant, le groupe placebo s'amoindrirait, ce qui empêcherait de comparer sur une longue durée le groupe vacciné et le groupe placebo. Le risque est encore plus grand pour les dizaines de projets qui n'ont pas encore commencé leurs essais à grande échelle : qui prendra le risque de recevoir un placebo, si un vaccin est déjà disponible en pharmacie ? Le sujet a été discuté jeudi lors d'une réunion du comité consultatif de la FDA sur les vaccins, mais sans réelle solution. Doran Fink, du bureau des vaccins de la FDA, a noté que les essais pourraient continuer dans les populations pour lesquelles aucun vaccin n'a encore été autorisé, ou pour qui aucune dose n'est encore disponible. Mais pour la majorité, le dilemme est réel.

Les gens demandent
« Nous sommes conscients que des situations pourraient apparaître où il n'est éthiquement plus permis, et donc plus faisable, de continuer le suivi placebo dans un essai, ou de commencer un essai contrôlé avec placebo », a admis jeudi Doran Fink. « Je n'ai pas de solution spécifique », a-t-il concédé. « A ce stade, nous avons demandé aux fabricants de vaccins et autres agences gouvernementales impliquées dans les essais de réfléchir à la façon dont ils pourraient retenir les volontaires dans les essais cliniques ».
L'une des deux sociétés tablant sur une demande d'autorisation conditionnelle d'ici fin novembre aux Etats-Unis, Moderna (l'autre est Pfizer), a officiellement demandé aux autorités des consignes. « Les participants commencent déjà à demander quand ils pourront savoir s'ils ont reçu le vaccin ou le placebo », a dit Jacqueline Miller, s'exprimant au nom de la société lors de la même réunion. Pfizer et son partenaire allemand BioNTech ont de leur côté écrit dans une lettre à la FDA qu'ils auraient la « responsabilité éthique » d'informer les membres du groupe placebo, et demandé à l'agence d'être « ouverte » à d'autres méthodes pour continuer à évaluer les vaccins. Pour l'instant, la FDA n'a qu'une instruction : continuez les essais tant que cela reste « faisable ».