Contre le coronavirus, la piste des anticorps de synthèse prend forme
Publié le - par Le blob.fr, avec l'AFP

Les signes encourageants se multiplient ces derniers jours autour des traitements à base d’anticorps de synthèse contre le Covid-19, l’une des pistes principales pour lutter contre la pandémie parallèlement aux vaccins.
Qu’est-ce que c’est ?
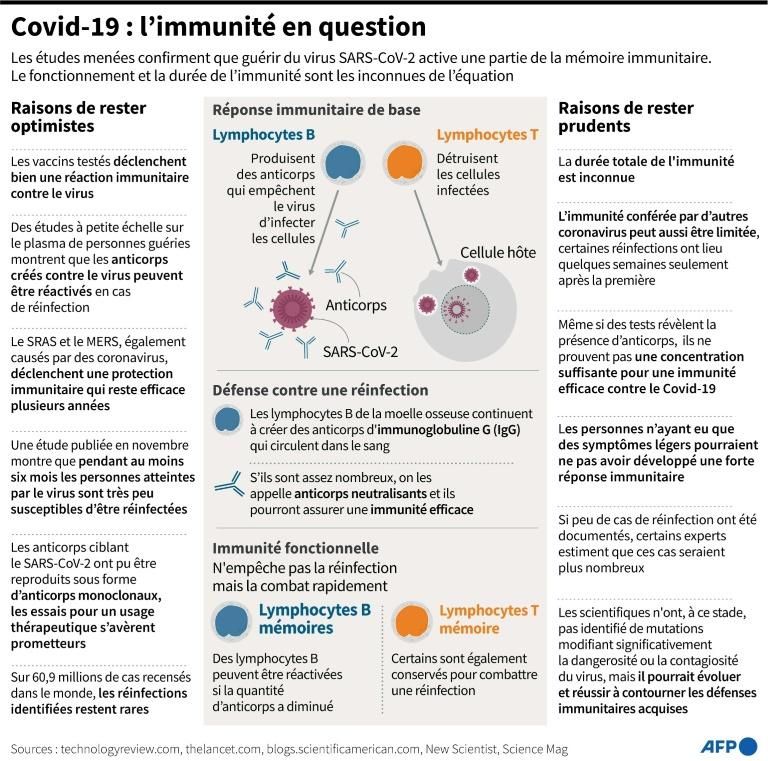
Les anticorps sont l’une des bases de notre système immunitaire. Face à la présence d’un élément dangereux, tel un virus, notre corps en produit naturellement pour repérer l’envahisseur. L’idée des anticorps de synthèse, c’est de sélectionner des anticorps naturels et de les reproduire artificiellement pour les administrer ensuite en traitement, généralement par une perfusion. C’est différent d’un vaccin. Celui-ci vise à ce que le corps produise par lui-même les bons anticorps. Les anticorps de synthèse sont, eux, injectés une fois que la maladie s’est déclarée pour suppléer aux lacunes du système immunitaire. Ces traitements utilisent des anticorps « monoclonaux », c’est-à-dire qui reconnaissent une molécule précise du virus ou de la bactérie visés.
C’est nouveau ?
Non. « Les anticorps monoclonaux sont l’un des outils les plus puissants de la médecine moderne », souligne la fondation britannique Wellcome.
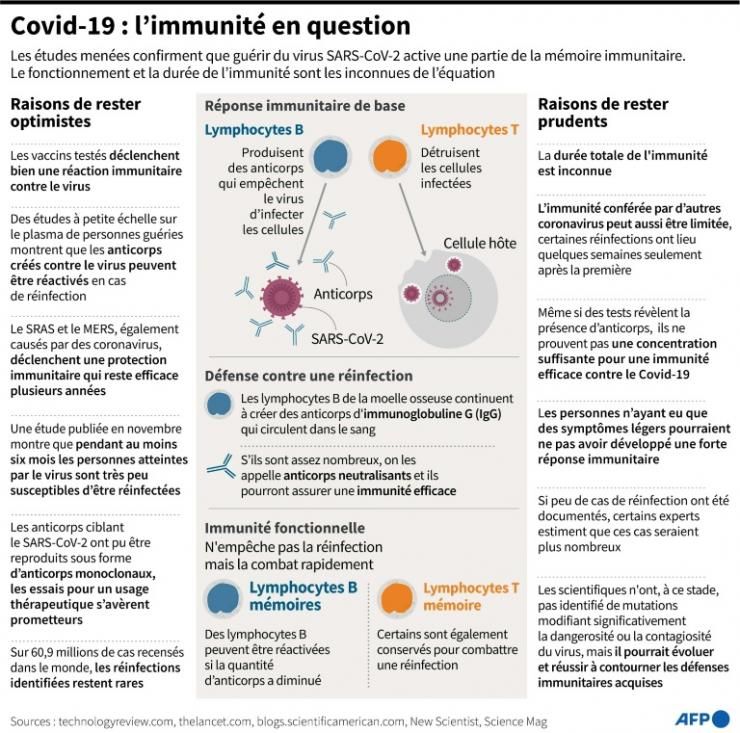
Ces traitements existent depuis une trentaine d’années et une centaine d’entre eux sont actuellement brevetés. Mais, jusqu’à maintenant, ils se concentraient essentiellement sur les cancers ou les maladies résultant d’un dysfonctionnement du système immunitaire, comme celle de Crohn, et non les infections comme le Covid-19. Mais les anticorps de synthèse « ont toujours eu un potentiel énorme pour combattre directement une infection », souligne l’immunologue britannique Alexander Edwards, de l’université de Reading. La pandémie a donc stimulé ce pan de la recherche sur les anticorps de synthèse, ce qui pourrait plus largement donner lieu à une « percée » dans leur usage contre les infections, selon M. Edwards.
Quelle efficacité face au virus ?
Les projets les plus avancés sont au nombre de quatre : le géant britannique GSK en partenariat avec le laboratoire californien Vir, l’américain Regeneron, son compatriote Eli Lilly et le sud-coréen Celltrion. Cette semaine, deux d’entre eux ont fait des annonces encourageantes après des tests de phase 3, c’est-à-dire auprès de centaines de personnes et en vue d’une rapide mise sur le marché.

Eli Lilly a d’abord annoncé mercredi une très forte réduction (-87 %) des hospitalisations et décès chez les patients ayant reçu un « cocktail » de deux anticorps, bamlanivimab et etesevimab. Jeudi, ce sont GSK et Vir qui ont suivi avec des données du même ordre (-85 %) sur leur anticorps VIR-7831. Celltrion a déjà fait part en janvier de résultats favorables pour l’anticorps regdanvimab, puis Regeneron a fait de même quelques semaines plus tard pour son REGN-COV2, cocktail de casirivimab et d’imdevimab.
Où sont-ils autorisés ?
Seuls ceux de Regeneron, Eli Lilly et Celltrion (seulement en Corée du Sud) ont reçu des autorisations à ce jour. Dans plusieurs pays, ils ont d’abord été homologués en urgence, avant même que des résultats permettent de conclure avec le plus haut niveau de rigueur à leur efficacité. Pour Regeneron, les États-Unis ont donné une telle autorisation pour REGN-COV2 en novembre 2020 ; le président Donald Trump en avait lui-même bénéficié avant cela, début octobre.
L’Agence européenne des médicaments (EMA) a, elle, donné fin février, un avis favorable pour les patients qui ne présentent pas un risque élevé d’évolution vers une forme sévère du Covid-19. Le bamlanivimab d’Eli Lilly est autorisé aux États-Unis et en France pour les plus de 80 ans. Mais ce choix ne fait pas l’unanimité dans le corps médical français car l’autorisation ne concerne que cet anticorps seul (et non en cocktail avec l’etesemivab), et l’efficacité est dans ce cas de figure nettement moins claire.
Les autorités européennes viennent de commencer l’évaluation du cocktail d’Eli Lilly. L’UE a aussi entamé l’évaluation du médicament de Celltrion. Enfin, GSK et Vir ont, eux, prévu de solliciter une autorisation d’utilisation en urgence aux États-Unis et dans d’autres pays.
Quelles limites ?
Elles sont de deux ordres. D’abord, il y a les interrogations sur l’efficacité de ces traitements face à l’émergence des variants du coronavirus, de nouvelles souches qui risquent de rendre les anticorps obsolètes. Selon Sophie Muller, directrice médicale de GSK France, « l’anticorps développé par le groupe cible une région de la protéine S (spike) qui n’est pas concernée par les variants actuels du coronavirus, d’où son intérêt ».
Mais cela ne répond pas au risque d’émergence de futurs variants éventuellement résistants. Dans cette idée, certaines recherches misent plutôt sur le développement d’anticorps « polyclonaux », en mesure d’identifier immédiatement bien plus de molécules du virus. L’autre limite, c’est le prix et la disponibilité. L’injection d’un anticorps d’Eli Lilly coûte de l’ordre de 1 000 euros. Mais cela reste moins cher qu’une hospitalisation, disent les médecins. Quant à la disponibilité, les capacités de production encore insuffisantes devront croître pour garantir une utilisation à grande échelle.