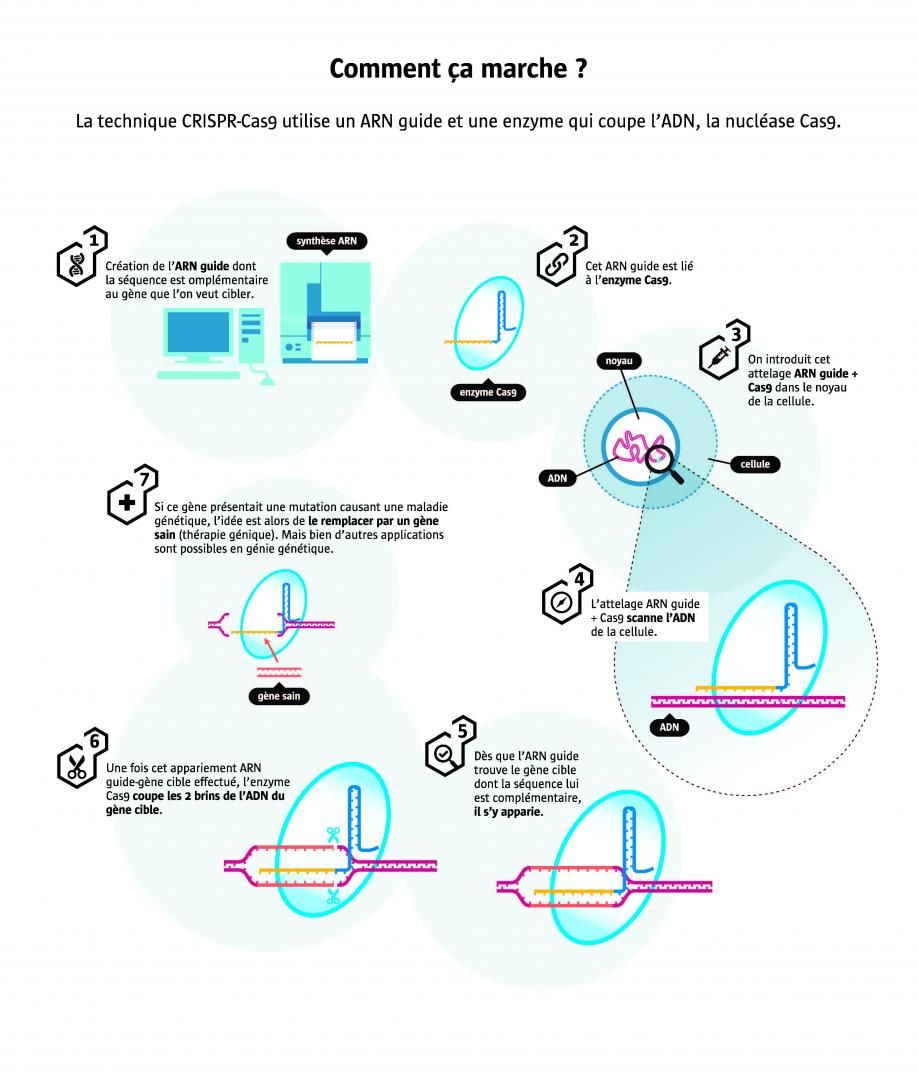
Crispr-Cas9 : la révolution génétique
Depuis 2012, une nouvelle technique a fait irruption dans les laboratoires de génétique. Baptisée CRISPR-Cas9, elle permet de manipuler le génome d’un grand nombre d’espèces et ouvre la voie à de multiples applications. Le prix Nobel de chimie 2020 vient d’être décernée aux deux auteures de cette découverte : la Française Emmanuelle Charpentier et l’Américaine Jennifer Doudna.
LeBlob - Publié le , mis à jour le
En 2012, une Française et une Américaine créent un outil de génie génétique aussi efficace qu'imprononçable : « CRISPR-Cas9 ». Huit ans plus tard, il s'est répandu comme une trainée de poudre dans les laboratoires du monde entier et vaut à ses co-inventrices de recevoir le prix Nobel de chimie 2020. La raison de ce succès ? Il permet facilement de supprimer, activer, inhiber ou remplacer n'importe quel gène, et tout cela à moindre coût, ce qui démocratise l’étude des gènes. Aujourd'hui CRISPR-Cas9 attire des millions de dollars... et fait déjà l'objet d'une guerre de brevets ! L'enjeu est de taille car ses applications potentielles sont innombrables, au premier rang desquelles la thérapie génique avec déjà des essais encourageants chez l'animal. Mais cette technique suscite aussi des inquiétudes... En Chine, CRISPR-Cas9 a déjà été utilisée pour manipuler des embryons humains, laissant craindre la création de « bébés CRISPR sur mesure ». Focus sur l'incroyable destin de cet outil révolutionnaire inspiré des bactéries.
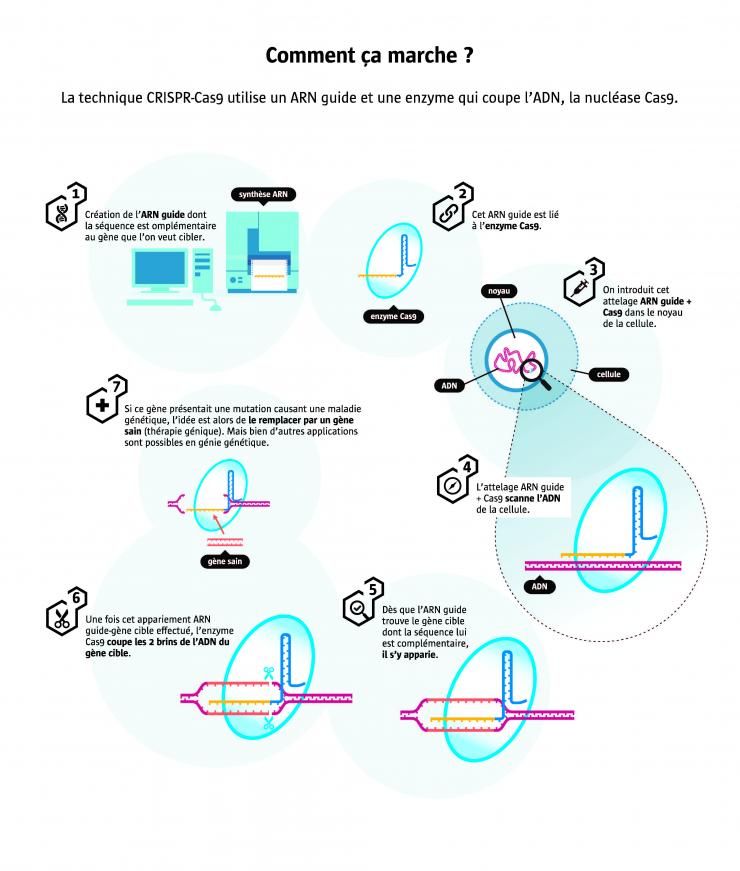
Une épopée scientifique et mondiale
Qui aurait imaginé qu'un mécanisme de défense découvert chez des bactéries allait déboucher 30 ans plus tard sur un outil de génie génétique révolutionnaire ?
En 1987, dans un laboratoire de l’université d'Osaka, le Japonais Atsuo Nakata découvre d'étranges séquences d'ADN répétitives dans le génome de bactéries : à certains endroits, les quatre lettres constitutives de l’ADN – adénine (A), thymine (T), cytosine (C), guanine (G) - forment des suites lisibles dans les deux sens... comme les palindromes ! Cette curiosité génétique suscite alors peu d'intérêt. Il faudra attendre 15 ans pour que des scientifiques de l’université néerlandaise d’Utrecht donnent un nom à ces séquences : « CRISPR » pour Clustered Regularly Interspaced Short Palindromic Repeats. En 2005, des bioinformaticiens français et espagnols découvrent que l'ADN intercalé entre ces palindromes est souvent de l’ADN de bactériophages, des virus capable d’infecter des bactéries. Deux ans plus tard, des chercheurs danois observent que des bactéries utilisées dans l'industrie laitière survivent mieux aux infections virales lorsqu'elles possèdent des CRISPR. Celles-ci agiraient donc comme une sorte de vaccin ! Plusieurs équipes dans le monde tentent alors de comprendre leur mode d’action. C'est ainsi qu'avec ses collègues, la Française Emmanuelle Charpentier découvre que CRISPR s'allie à l'enzyme « Cas9 » pour repérer et couper l'ADN des virus qui pénètrent dans les bactéries, éliminant ainsi l’infection virale. Mieux encore, avec l’Américaine Jennifer Doudna, elle parvient à détourner ce système de défense bactérien pour détecter et couper n'importe quel gène. À la clef : un nouvel outil de génie génétique aussi simple qu'efficace ! En août 2012, cette prouesse leur vaudra une publication dans la revue américaine Science qui va faire boule de neige...

Des CRISPR dans nos yaourts !
En 2007, l’industriel laitier danois Danisco fait une découverte intéressante : dans les bactéries Streptococcus thermophiles qu’il utilise pour fabriquer des yaourts et des fromages, celles qui ont des séquences CRISPR dans leur génome survivent mieux aux infections virales. Tout se passe comme si ces bactéries archivaient, dans leurs séquences CRISPR, l’ADN des virus les ayant préalablement infectées, puis s’en servaient ensuite pour repérer ces virus et les combattre. Un mécanisme de défense tout à fait efficace.

De nombreux succès
Bactéries, levures, mouches, riz, poissons-zèbres, rongeurs… et même des primates : rien ne résiste à CRISPR-Cas9, véritable couteau suisse de la génétique !
Peu après sa mise au point en 2012, la technologie CRISPR-Cas9 se développe dans les laboratoires de génétique. Dès janvier 2013, quatre équipes testent son efficacité sur des cellules humaines. Puis des chercheurs de l’université de Californie parviennent à créer des variantes de la technologie CRISPR-Cas9 qui permettent non seulement de couper le gène cible mais aussi de le remplacer par un autre, de l'activer ou de l'inhiber. Tout cela n’est pas nouveau mais CRISPR-Cas9 permet de le faire bien plus simplement et à un coût environ dix fois moindre que les outils de la génération précédente. Résultat : les applications s’enchaînent pour modifier des gènes d’organismes aussi divers que variés : bactéries, levures, riz, mouches, nématodes, poissons-zèbres, rongeurs... En février 2014, une autre étape est franchie : le succès de CRISPR-Cas9 sur des primates. À l’université médicale de Nanjing en Chine, des chercheurs ont en effet réussi à donner naissance à des jumeaux macaques génétiquement modifiés avec CRISPR-Cas9. Quelques mois plus tard, une équipe américaine parvient à guérir des souris atteintes d'une maladie génétique incurable du foie, premier exemple de thérapie génique avec cette technique. En 2015 et 2016, les recherches se multiplient. Des équipes utilisent CRISPR-Cas9 pour, par exemple, essayer de rendre les organes de cochons plus facilement transplantables à l'homme, empêcher les moustiques de transmettre le paludisme, s’attaquer aux bactéries résistantes aux antibiotiques (1), ou encore améliorer les animaux d'élevage et les plantes cultivées.
(1) La start-up Eligo Bioscience hébergée à l’Institut Pasteur a pour objectif de développer, grâce à CRISPR-Cas9, une nouvelle génération d’antibiotiques capables de détruire spécifiquement les bactéries devenues résistantes.
Les cochons en ligne de mire
Parmi les espèces visées par CRISPR-Cas9, le cochon figure en bonne place. Fin 2015, un institut de génétique chinois a ainsi lancé la commercialisation de « microcochons » comme animaux de compagnie, créés grâce à ce nouvel outil. Des agronomes sud-coréens l'utilisent, quant à eux, pour augmenter la masse musculaire des cochons d'élevage. Autre application, beaucoup moins anecdotique : « humaniser » les organes de cochons pour éviter leur rejet une fois greffés à des patients. Dans cette optique, une équipe de l’université Harvard aux États-Unis a déjà inactivé plus de 60 gènes chez des cochons grâce à CRISPR-Cas9.


CRISPR marche aussi sur les primates
En utilisant ce nouvel outil, le biologiste Jiahao Sha et ses collègues de l’université médicale de Nanjing en Chine sont parvenus, en février 2014, à modifier le génome d’embryons de macaques (constitués de quelques cellules) qui, une fois transférés dans des mères porteuses, ont donné naissance, pour l’une d’entre elles, à des jumeaux viables. Leur ADN porte bien les deux gènes modifiés par CRISPR-Cas9, sans mutation sur le reste du génome. Une première qui ouvre la voie, selon les auteurs de l’étude, au développement de modèles primates de certaines maladies génétiques.
Un espoir pour la thérapie génique ?
La technologie CRISPR-Cas9 s’avère prometteuse pour la thérapie génique, autrement dit pour corriger des mutations génétiques causant des maladies incurables.
En mars 2014, des chercheurs du Massachusetts Institute of Technology (MIT) à Boston franchissent une première étape vers une application médicale de CRISPR-Cas9. Ils utilisent cette technique sur des souris pour tenter de les guérir d’une maladie génétique incurable du foie : la tyrosinémie, liée à une mauvaise dégradation de l’acide aminé tyrosine. Résultat : CRISPR-Cas9 permet de corriger 0,5% des cellules du foie. Un faible pourcentage mais au bout d’un mois, les cellules saines ont proliféré et représentent un tiers de tous les hépatocytes… de quoi permettre aux souris de survivre sans le traitement de référence. En août 2014, des chercheurs de l’Université du Texas s’attaquent à une autre maladie génétique incurable : la myopathie de Duchenne, une dégénérescence musculaire due à une mutation dans le gène de la dystrophine, protéine indispensable au bon fonctionnement des fibres musculaires. Cette fois, les chercheurs corrigent le gène dans des embryons de souris qu’ils réimplantent dans des mères porteuses. Neuf mois après leur naissance, certaines souris ont des muscles parfaitement normaux. Un succès avec la myopathie de Duchenne confirmé le 31 décembre 2015 par trois nouvelles études parues dans la revue Science. Ces résultats suscitent un réel espoir pour la thérapie génique. Mais avant d'envisager l’utilisation de CRISPR-Cas9 chez des patients, de nombreux points devront être vérifiés. Il faudra notamment s'assurer que l'outil n'entraine aucune lésion dans les régions du génome non ciblées (des mutations non voulues sont parfois observées), tout en optimisant le nombre de cellules correctement corrigées.
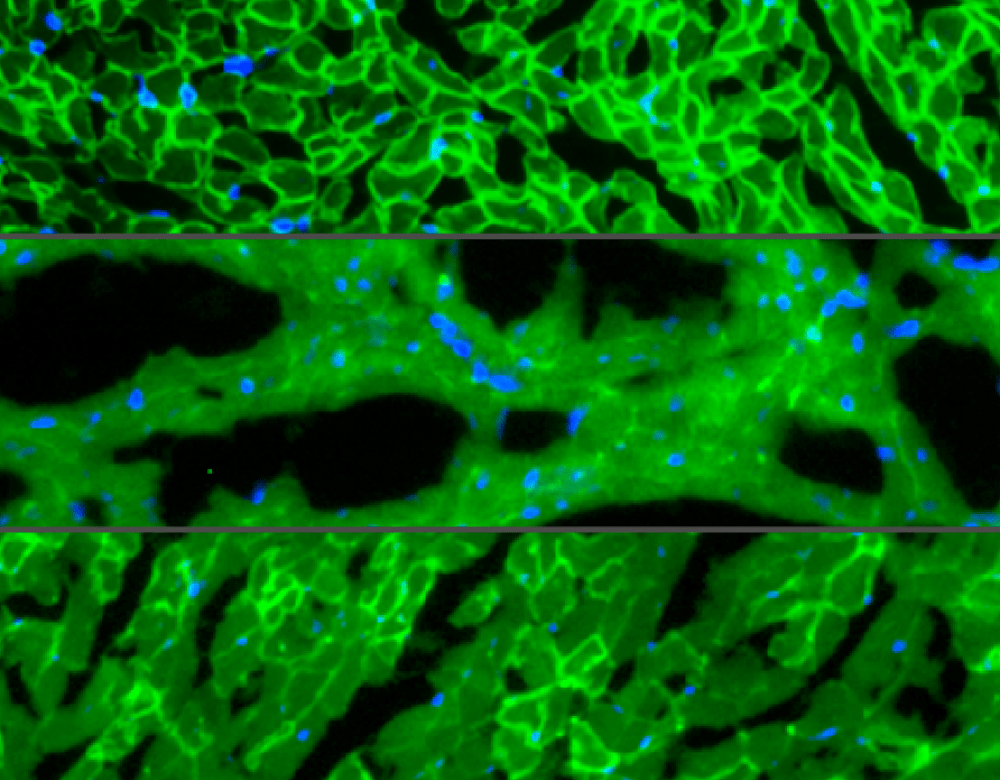
Myopathie de Duchenne : premiers succès sur des souris
À elle seules, ces trois photos de muscle cardiaque de souris résument un grand succès de CRISPR-Cas9. Il a été obtenu fin 2015 par des chercheurs américains sur la myopathie de Duchenne. Dans cette pathologie, un gène est défectueux : celui codant pour la dystrophine, une protéine indispensable au bon fonctionnement des cellules musculaires. Marquée en vert fluo, la dystrophine est logiquement omniprésente chez les souris saines (en haut), et absente chez les malades (au centre)... Mais en corrigeant le gène défectueux, CRISPR-Cas9 a relancé sa production (en bas).
Vers un « bébé CRISPR » ?
Utiliser CRISPR-Cas9 pour concevoir des bébés sur mesure et améliorer l'espèce humaine. Ce risque de dérive eugénique est pris très au sérieux.
En avril 2015, une publication déclenche une polémique planétaire. Une équipe chinoise s’est en effet servie de CRISPR-Cas9 pour tenter de modifier le génome d’un embryon humain. Première mondiale, cette modification du patrimoine héréditaire de l’espèce humaine contrevient à la convention d’Oviedo ratifiée par la France et 28 autres pays européens en 2011. Car, même s’il s’agit comme ici de prévenir le développement d’une maladie génétique (la bêta-thalassémie), modifier le génome d'un embryon humain c'est aussi modifier celui de ses futures cellules sexuelles... et donc de toute sa descendance potentielle. Bref, la porte ouverte à l’eugénisme. Nouveau rebondissement début 2016 lorsque la Grande Bretagne autorise l'utilisation de CRISPR-Cas9 sur des embryons humains, à la demande de scientifiques de l’Institut Francis Crick (Londres). Leur objectif est de mieux comprendre le développement embryonnaire précoce afin de limiter le risque de fausses couches lors des fécondations in vitro. Les embryons modifiés ne seront pas réimplantés chez des femmes mais systématiquement détruits au bout de sept jours. Face à ces premières expérimentations et aux questions éthiques qu’elles soulèvent, des chercheurs, dont Jennifer Doudna, co-inventrice de CRISPR-Cas9, tirent la sonnette d’alarme. Certains vont même jusqu’à demander un moratoire sur les modifications qui pourraient être transmises à la descendance. Au-delà de ce risque de dérive eugénique, cette technique à la portée de n'importe quel biologiste soulève une autre question : des « bio-hackers » pourraient-ils la détourner pour produire des armes biologiques ?

Des « bébés Crispr » bientôt en Russie ?
Le scientifique russe Denis Rebrikov a révélé son intention de produire des bébés génétiquement modifiés selon la méthode Crispr-Cas9. Il serait ainsi le second individu à réaliser un tel acte, après le biologiste chinois He Jiankiu, à la fin 2018. La création de ces bébés « génétiquement modifiés » avait entraîné une ferme condamnation de toute la communauté scientifique mondiale (et la suspension des fonctions professionnelles du biologiste par les autorités chinoises). S’il en obtient l’autorisation, le biologiste moléculaire russe envisage d’implanter des embryons génétiquement modifiés chez des femmes en ciblant le même gène que son prédécesseur chinois, appelé CCR5. Mais Denis Rebrikov estime sa technique moins contestable sur le plan éthique, car il s’agit de permettre l’implantation des embryons dans les mères séropositives et résistantes aux traitements habituels.
La première étude qui a créé la polémique
En 2015, une équipe de l’université Sun-Yat-sen de Canton teste l’efficacité de CRISPR-Cas9 pour corriger le gène responsable d'une maladie génétique du sang, la bêta-thalassémie. Les chercheurs utilisent pour cela 80 embryons humains non viables, issus de fécondations in vitro. Le résultat est mitigé puisque de nombreux embryons présentent à la fois des cellules où l'ADN a été corrigé et d'autres où il ne l’a pas été ; les experts parlent de « structure mosaïque ». Mais cette tentative de modification du génome d’un embryon humain suscite un vif débat, certains y voyant un premier pas vers l'eugénisme.

Un outil lucratif
Laboratoires pharmaceutiques, multinationales de l'agrobusiness... et même Google : tous veulent leur part du gâteau. Des millions de dollars sont déjà sur la table.
Véritable poule aux œufs d'or en puissance, CRISPR-Cas9 aiguise bien des appétits financiers. Parmi les acteurs en embuscade, les grands laboratoires pharmaceutiques. Récemment, le géant Bayer a investi quelque 300 millions de dollars dans une société commune avec CRISPR Therapeutics, la startup cofondée par la Française Emmanuelle Charpentier. Objectif de cette « joint-venture » : développer de nouveaux traitements notamment pour des maladies sanguines et cardiaques. Novartis, autre géant du secteur pharmaceutique, s'est quant à lui allié à Intellia Therapeutics, une société qui frise déjà les 100 millions de dollars de fonds et qu'a récemment rejoint l’Américaine Jennifer Doudna, l'autre « mère » de CRISPR-Cas9. Toutefois, les « big pharmas » ne sont pas les seuls à s'intéresser au couteau suisse de la génétique. En 2015, les deux co-inventrices de CRISPR-Cas9 ont ainsi reçu six millions de dollars dans le cadre du Prix « Breakthrough 2015 in Life Sciences » créé par les fondateurs de Facebook et Google. Avec la Fondation de Bill Gates, le célèbre moteur de recherche fait aussi partie d'un consortium qui a récemment investi 120 millions de dollars dans Editas, une autre société cofondée par Jennifer Doudna. Cette dernière a aussi créé Caribou Biosciences, une entreprise alliée au géant de l'agrobusiness DuPont pour améliorer ses semences grâce à CRISPR-Cas9. Bref, on n’a pas fini d’entendre parler de cette technique, et pas seulement à la rubrique « science ».
Guerre de brevets
Vu les espoirs soulevés par CRISPR-Cas9, certains essayent de s’accaparer la propriété intellectuelle de cet outil révolutionnaire de génie génétique. C’est le cas de Feng Zhang du Broad Institute à Cambridge, et l’un des cofondateurs d’Editas Medicine. En 2014, ce dernier est parvenu à faire valider un brevet sur cette invention aux États-Unis, grâce à une procédure accélérée. Cette stratégie lui a permis de prendre de court les deux chercheuses ayant mis au point CRISPR-Cas9 : elles avaient déposé un brevet dès 2013... mais il est toujours en cours d’instruction ! L’affaire est aujourd’hui gérée par avocats interposés.
Deux chercheuses... quatre entreprises
Les deux co-inventrices de CRISPR-Cas9 ont déjà fondé des sociétés pour exploiter cet outil, notamment à des fins médicales : CRISPR Therapeutics pour la Française Emmanuelle Charpentier (à gauche), Caribou Biosciences et Editas Medicine pour l'Américaine Jennifer Doudna (à droite). En avril 2015, cette dernière a quitté Editas pour Intellia Therapeutics, entreprise issue de Caribou Biosciences.