Chimie : le tableau périodique revisité
Il y a 150 ans, en classant les éléments chimiques dans son tableau périodique, Dmitri Mendeleïev a jeté les bases d’un ordre qui structure encore la chimie actuelle.
Enquête de Sébastien Descotes-Genon, Nicolas Graner, Séverine Martrenchard, Sylvie Salamitou (Compas, université Paris-Sud) - Publié le
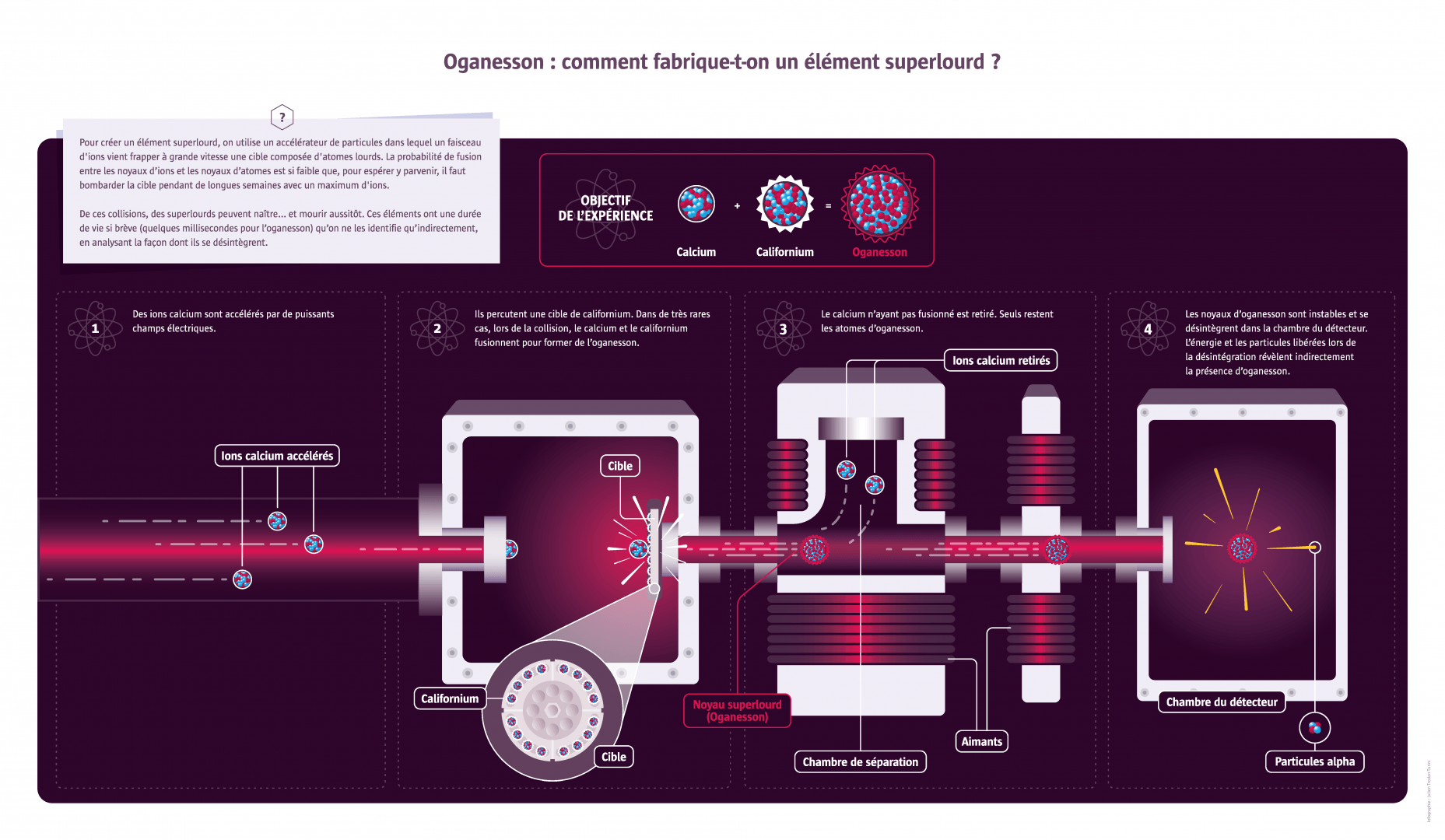
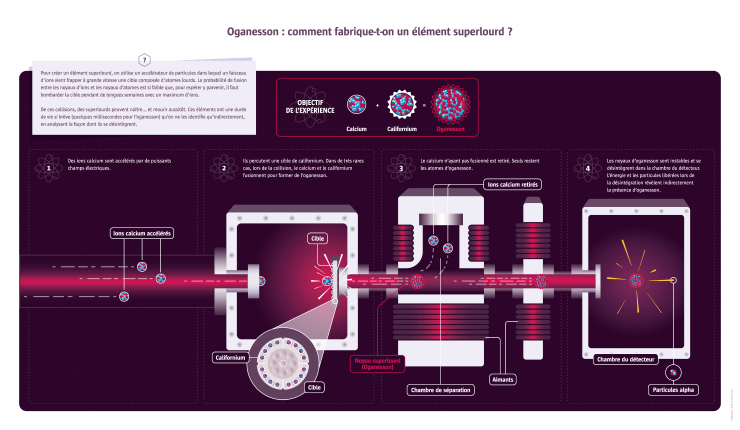
150 ans après la conception de la classification périodique des éléments chimiques par Dmitri Mendeleïev, son célèbre tableau est toujours au centre d’une intense activité de recherche. Après avoir progressivement identifié tous les éléments naturels, les chercheurs créent à présent de nouveaux éléments. Les quatre plus récents ont rejoint le tableau en 2016, portant le total à 118 éléments, et la chasse aux « superlourds » se poursuit. Objet de vastes collaborations entre chercheurs du monde entier, théoriciens et expérimentateurs, chimistes et physiciens, cette quête suscite aussi des rivalités entre pays ou entre communautés scientifiques. Quels sont donc les enjeux de ce programme de recherche qui se prolonge à travers les siècles ?
150 ans après Mendeleïev
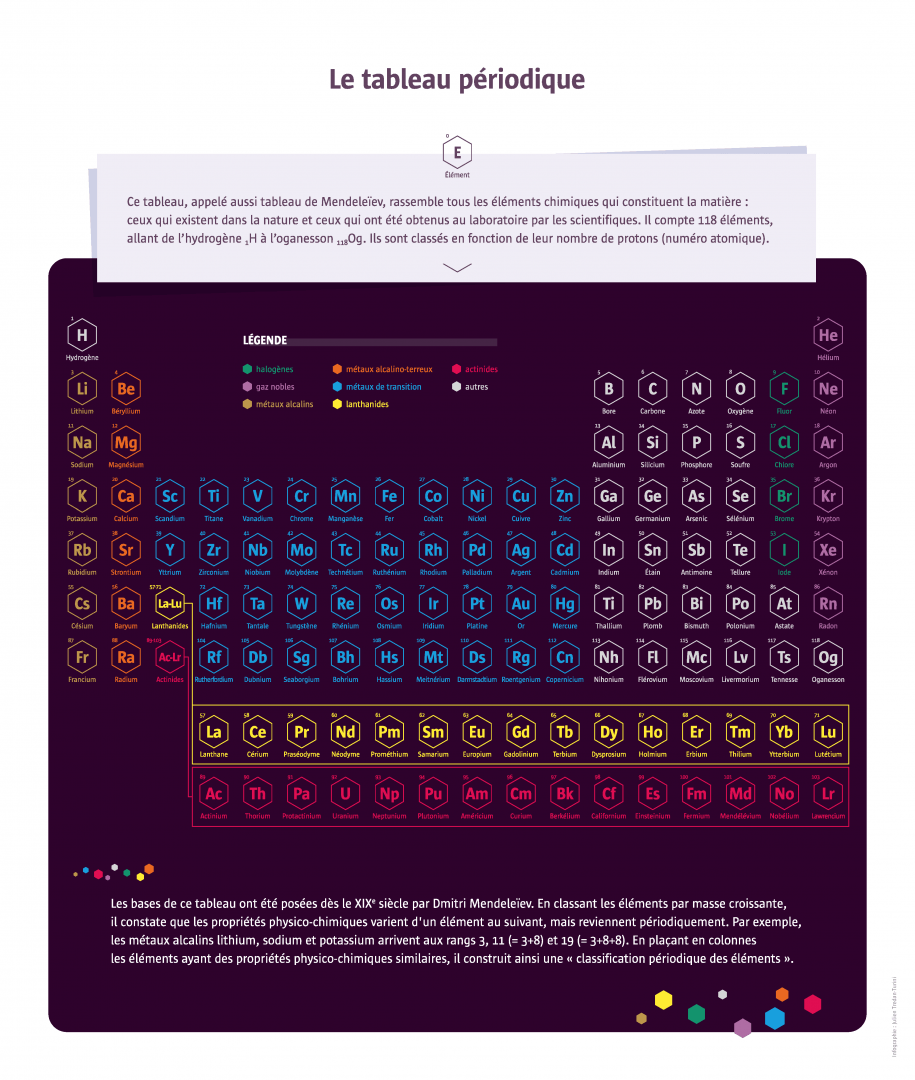
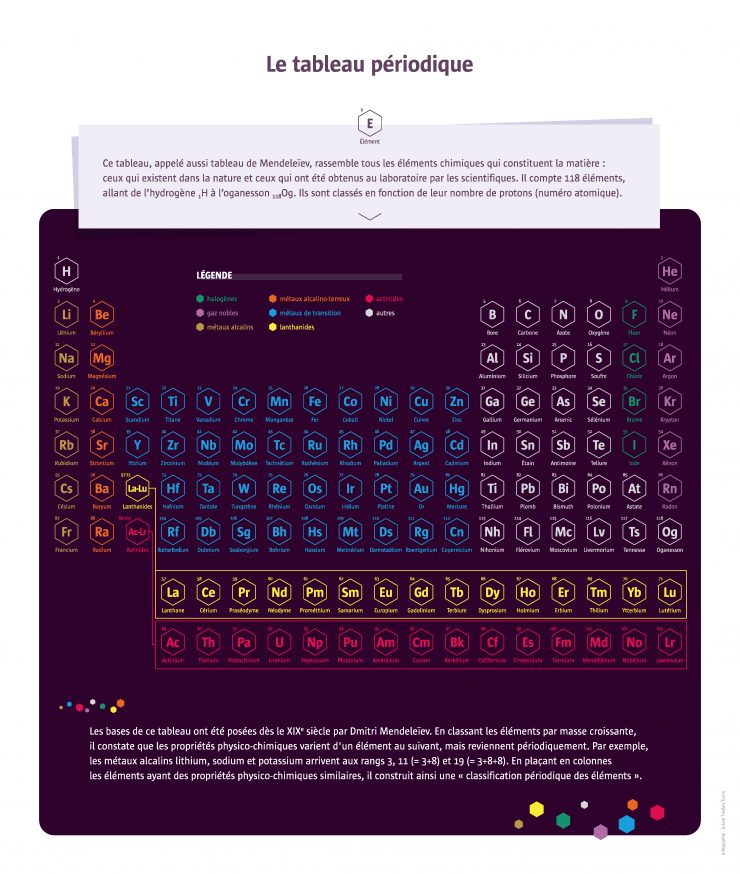
Le Russe Dmitri Mendeleïev publie en 1869 une classification en six lignes de la soixantaine d’éléments alors connus. L’idée d’une régularité dans les propriétés des éléments est dans l’air du temps : le chimiste français Chantcourtois a déjà proposé une classification en 1862 et bien d’autres s’y sont essayés ensuite. Mais Mendeleïev apporte plusieurs améliorations, notamment en laissant des cases vides qui lui permettent de prédire l’existence de nouveaux éléments et leurs propriétés. Il faudra près de 150 ans de recherche pour compléter le tableau de 118 éléments sur sept lignes. Les chercheurs attaquent aujourd’hui la huitième ligne...
Les éléments, au cœur de la matière
Comme les briques d’un jeu de construction, une centaine d’éléments
chimiques engendrent, par leurs combinaisons, l’infinie variété de la matière.
En 1789, le chimiste français Antoine Lavoisier a donné du mot « élément » une définition compatible avec ce que l’on connaît aujourd’hui de la structure atomique de la matière : « Un élément chimique est un corps simple qui ne peut plus être décomposé ». Tout ce qui existe sur Terre et dans l’Univers est issu de l’assemblage de ces éléments. Certaines substances sont constituées d’un seul élément : par exemple, les métaux (fer, cuivre, or...), le charbon (sous forme d’anthracite) qui est du carbone pur, ou certains gaz (diazote et dioxygène de l’air, dihydrogène). À l’inverse, d’autres substances sont composées de plusieurs éléments, comme l’eau, avec 1/3 d’oxygène et 2/3 d’hydrogène. Certains éléments chimiques sont très abondants sur Terre – le plus abondant dans les océans est l’hydrogène ; dans la croûte terrestre, c’est l’oxygène –, d’autres très rares, comme l’astate dont il n’existe que quelques grammes sur notre planète. Un grand nombre d’éléments ont été isolés à partir de substances connues. D’autres étaient insoupçonnés avant leur identification par les chimistes, comme l’argon, un « gaz noble » de l’air. Les tout derniers éléments découverts par les physiciens n’existent pas dans la nature. Ils sont très instables et se désintègrent très vite après s’être formés. Ils sont créés en laboratoire dans des accélérateurs de particules, dans le cadre de recherches visant à explorer la nature fondamentale de la matière.
Des poussières chimiques d’étoiles
Si quelques éléments remontent aux premiers instants de l’Univers, la plupart sont le fruit de réactions nucléaires au coeur des étoiles.
Il y a environ 13,7 milliards d’années a lieu le Big Bang... En une fraction de seconde se forment de nombreuses particules dont les protons et les neutrons. Au bout de quelques minutes, elles s’assemblent pour former des éléments légers : si l’hydrogène, constitué d’un seul proton, domine largement, l’hélium à deux protons et deux neutrons constitue alors 25 % de la matière. Des traces de lithium sont aussi présentes. Pour obtenir des éléments plus lourds, il faut obliger les noyaux à fusionner malgré des charges électriques qui se repoussent. Cela nécessite une énergie considérable qu’on ne trouvera que bien plus tard, au coeur des étoiles. C’est là que se sont formés tous les éléments que nous connaissons : carbone, oxygène, fer... Quand une étoile meurt, elle explose et projette dans l’espace tous ces éléments, qui se retrouvent dans les générations suivantes d’étoiles et de planètes. Parmi ceux formés dans les étoiles, certains sont instables, ou radioactifs, et se désintègrent spontanément au bout d’un temps caractéristique de l’élément. Sur Terre, seuls trois éléments radioactifs subsistent depuis l’origine de la planète grâce à leur durée de vie de plusieurs milliards d’années : potassium 40, uranium et thorium. Quelques éléments radioactifs à vie plus courte se forment continuellement, comme le radium (1600 ans) issu de la désintégration de l’uranium, ou le carbone 14 (5700 ans). Mais pour la plupart des éléments radioactifs, le seul moyen d’observation est la synthèse en laboratoire, en recréant à toute petite échelle des conditions semblables à celles des étoiles.
Production de choc chez les supernovae !
Pour la production d’éléments chimiques, toutes les étoiles ne se valent pas. Une étoile moyenne, comme le Soleil, produit de l’hélium à partir d’hydrogène pendant la plus grande partie de sa vie. Une fois l’hydrogène épuisé, elle crée en peu de temps des éléments jusqu’à l’oxygène pour le Soleil, voire jusqu’au fer pour une étoile plus grosse. Les éléments plus lourds que le fer nécessitent tellement d’énergie qu’ils ne peuvent se former que dans des étoiles très massives, juste avant qu’elles n’explosent. Le bouquet final, au cours duquel ces éléments sont dispersés dans l’espace, est une supernova. Comme celle-ci, photographiée par le télescope spatial Hubble dans la constellation de la Vierge.

La course de fond aux superlourds
Créer de nouveaux éléments de plus en plus lourds est un réel défi scientifique, mais l’enjeu peut aussi être géopolitique.
Après la Seconde Guerre mondiale, qui a révélé le potentiel de l’uranium (l’élément le plus lourd trouvé dans la nature) pour des applications civiles et militaires, deux pays s’engagent dans la course aux éléments les plus lourds possibles : les États-Unis et l’URSS. C’est aussi une manière de montrer leur supériorité technologique. Entre 1947 et 1980, les centres américains de Berkeley et Los Alamos et le centre soviétique de Dubna découvrent chacun une demi-douzaine de nouveaux éléments, parfois presque en même temps, ce qui donne lieu à des querelles d’antériorité. Ils seront ensuite rejoints par l’Allemagne et le Japon. Le dernier élément créé par les physiciens est l’oganesson, avec 118 protons et 176 neutrons. Signe de l’évolution des relations entre les pays participants et d’une recherche devenue mondiale, cet élément est découvert en 2012 à Dubna (nommé officiellement en 2016) par une collaboration rassemblant des scientifiques russes et américains. À présent, on ne cherche plus ces éléments superlourds pour des questions de prestige ou d’applications potentielles, mais pour mieux saisir au plan fondamental les forces qui régissent la cohésion de la matière. En effet, si sur le plan théorique les chercheurs comprennent globalement pourquoi les noyaux les plus lourds ont une durée de vie aussi courte, en revanche certaines subtilités restent à valider. Ainsi, certains noyaux superlourds avec des nombres bien particuliers de protons et de neutrons pourraient échapper à la règle et être beaucoup plus stables, se maintenant quelques minutes, voire quelques années, sans se désintégrer. Le vérifier expérimentalement constitue à l’heure actuelle un défi scientifique et technique.

Record de lourdeur à Dubna
Fondé en 1956, l’Institut unifié de recherches nucléaires de Dubna en Russie regroupe aujourd’hui plus de 1000 chercheurs de 18 pays. Plusieurs éléments superlourds y ont été synthétisés, dont le plus lourd actuellement connu, le numéro 118. Après une décennie de vérifications, il est venu compléter officiellement les cases du tableau périodique en 2016, en même temps que les éléments 113, 115, 117. Il a été nommé oganesson en l’honneur de Iouri Oganessian, un pionnier de ces recherches à l’Institut.
Le Japon en bonne place
Cet accélérateur de particules (Rilac) de l’institut Riken a permis de synthétiser l’élément 113, baptisé nihonium : le terme « Nihon » désigne, en japonais, le Japon (comme « Nippon »)... Les éléments superlourds ont une durée de vie trop courte pour qu’on puisse les observer directement. D’eux, on ne détecte que le signal qu’ils émettent en disparaissant pour se transformer, après de multiples désintégrations, en un élément plus stable. En mesurant l’énergie des particules émises lors de cette réaction en chaîne et en regardant le produit final, stable, on peut reconstituer le processus et identifier la nature de l’élément créé initialement. Ce processus complexe amène souvent des interprétations controversées.

Querelle de chapelle autour du tableau
Identifier les éléments naturels est le travail des chimistes, en créer de nouveaux celui des physiciens. Deux communautés soeurs et parfois rivales.
Historiquement, les chimistes ont été les premiers à découvrir et étudier les éléments du tableau périodique. Une tradition veut donc que l’Union internationale de chimie pure et appliquée (UICPA) soit impliquée dans la validation des nouveaux éléments découverts. Cependant, depuis plusieurs décennies, les physiciens sont ceux qui créent et caractérisent les nouveaux venus, notamment les superlourds comme le nihonium, le moscovium, le tennesse et l’oganesson. Car ces éléments étant très instables, il n’est pas possible de les identifier par des propriétés chimiques. Ce changement dans la caractérisation des éléments s’est accompagné d’un passage de l’implication des chimistes à celle des physiciens. C’est ainsi que l’Union internationale de chimie (UICPA) et l’Union internationale de physique (UIPPA) se sont disputées la découverte de nouveaux éléments, chacune accusant l’autre d’annoncer de nouveaux éléments sans avoir effectué une validation scientifique suffisante. En mai 2018, les deux sociétés ont finalement convenu que dorénavant elles annonceront les découvertes ensemble en s’appuyant sur les conclusions d’un comité d’experts commun, le Joint Working Party.


L’instrument Spiral2 du Ganil
Le Ganil (Grand Accélérateur National d’Ions Lourds), à Caen, est un laboratoire pour la recherche en physique nucléaire, dont l’un des objectifs est de produire des éléments superlourds. En 2008, les chercheurs ont annoncé avoir produit des noyaux contenant 120 et 124 protons, mais leur durée de vie de 10–18 seconde a été jugée trop courte pour constituer de nouveaux éléments. Une installation de nouvelle génération, Spiral2, a été inaugurée en 2016 pour créer des noyaux encore plus lourds, dont certaines théories prévoient qu’ils pourraient être plus stables que les précédents.